В ЛНФ ОИЯИ исследовали влияние заряда на морфологические изменения клеточной мембраны
Новости, 14 июля 2023
Группа ученых Лаборатории нейтронной физики ОИЯИ (ЛНФ ОИЯИ) в сотрудничестве с коллегами из Лаборатории информационных технологий ОИЯИ продолжают работы по исследованию взаимодействия бета-амилоидного пептида (Aβ25-35) с модельными липидными мембранами. Данные взаимодействия лежат в основе бета-амилоидной теории возникновения болезни Альцгеймера, объясняющей распад клеточных липидных мембран клеток мозга воздействием на них бета-амилоидным пептидом. Последний эксперимент ученых ОИЯИ показал, что ранее наблюдаемые морфологические преобразования мембран и их разрушение не зависят от наличия заряда в изучаемой системе.
С 2019 года ученые ОИЯИ при поддержке гранта РНФ № 19-72-20186 ведут работу по изучению свойств клеточных мембран и взаимодействий их с Aβ25-35. В 2021 году, в ходе предыдущего эксперимента, ученые впервые продемонстрировали, что взаимодействие Aβ25-35 с липидными мембранами являются источником морфологических изменений последних под влиянием температуры. Эти изменения затем приводят к разрушению мембран и гибели клеток. Взаимодействия пептида с модельными липидными мембранами изучались с помощью метода малоуглового рассеяния нейтронов на спектрометре ЮМО на реакторе ИБР-2 в ЛНФ ОИЯИ.
В новой работе, уже в 2022 году, учеными было исследовано влияние поверхностного заряда на морфологические изменения, запускаемые пептидами, путем введения анионного липида (липида с отрицательным зарядом) в незаряженную модельную мембрану. Изменения толщины мембраны и общей структуры мембраны с включенным Aβ25-35 и без него были исследованы в широком диапазоне температур.
«Наши результаты подтвердили данные предыдущего эксперимента: модельные липидные системы претерпевают морфологические преобразования во время фазового перехода. При понижении температуры и переходе липидов, из которых состоит модельная мембрана, в гелевую фазу в присутствии Aβ25-35 наблюдалось разрушение мембраны – распад везикул на бицеллоподобные структуры (плоские дискообразные структуры из одного бислоя липидов). В отсутствие Aβ25-35 целостность везикул сохранялась. Наличие заряда в изучаемой системе не повлияло на данный процесс», – подчеркнул один из исследователей, старший научный сотрудник ЛНФ ОИЯИ Александр Иваньков.
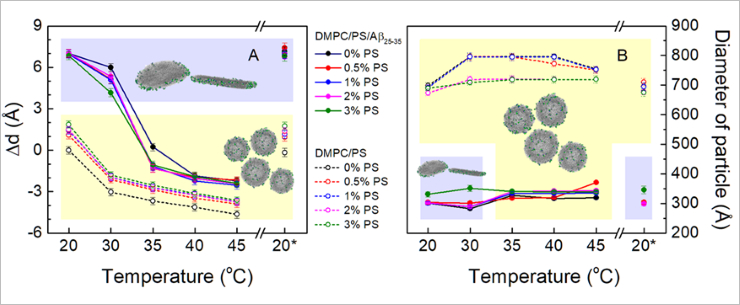 Относительное изменение толщины мембраны Δd (A) и диаметра бицеллоподобных структур и однослойных везикул (B), полученное в результате аппроксимации данных малоуглового рассеяния нейтронов
Относительное изменение толщины мембраны Δd (A) и диаметра бицеллоподобных структур и однослойных везикул (B), полученное в результате аппроксимации данных малоуглового рассеяния нейтронов
Болезнь Альцгеймера – это серьезное нейродегенеративное заболевание, характеризующееся прогрессированием деменции и полной потерей когнитивных функций. Понимание молекулярных основ развития заболевания необходимо не только для разработки методов терапии, но и для должной профилактики, а также ранней диагностики, которая крайне затруднена длительным течением бессимптомного этапа болезни. В этом смысле изучение липид-пептидных взаимодействий, приводящих к глобальным морфологическим изменениям в мембранах, может играть ключевую роль в понимании причин развития болезни Альцгеймера, отметил ученый.
Публикация
- Anionic lipids modulate little the reorganization effect of amyloid-beta peptide on membranes. Ivankov, O., D.R. Badreeva, E.V. Ermakova, T. Kondela, T.N. Murugova, and N. Kucerka. “Anionic Lipids Modulate Little the Reorganization Effect of Amyloid-Beta Peptide on Membranes”, General Physiology and Biophysics, vol. 42, no. 1 (2023): 59-66.